RNDr. Mgr. Kateřina Veverová, Ph.D., je kognitivní neurovědkyně, věnuje se výzkumu biologických a neuropsychologických markerů neurodegenerativních onemocnění. Vede laboratorní sekci projektu Validace specifických biomarkerů mitofagie v kontinuu Alzheimerovy nemoci (TAČR, KAPPA). Cílem projektu je definovat vztah markerů mitofagie v krevním séru a mozkomíšním moku u pacientů v různém stádiu AN a určit jejich vztah se standardními biomarkery AN (beta amyloid, tau, p-tau) a kognitivní výkonností. (vice na www.mitophagyad.eu). V rámci projektu bPRIDE (Blood Proteins for early Discrimination of dEmentias) JPND je jedním z členů mezinárodního konsorcia, jejichž hlavním cílem je identifikace a vývin panelu plasmatických biomarkerů pro včasnou a specifickou diagnostiku nejčastějších neurodegenerativních onemocnění (Alzheimerova nemoc, frontotemporální lobární degenerace, onemocnění s Lewyho tělísky) a převést jej do dostupného diagnostického testu. Působí na Neurologické klinice 2. LF UK a FNM a na Katedře psychologie FF UK.
Zjistili jste, že u Alzheimerovy nemoci dobře nefunguje recyklace poškozených mitochondrií v paměťových buňkách neboli mitofagie – podařilo se vám objevit příčinu nemoci?
Na to ještě s jistotou odpovědět neumíme – jsou ale důvody pro to věřit, že ano, protože to zapadá do takzvané amyloidové kaskádové hypotézy, na které panuje shoda.
Na čem je tato hypotéza založená a kde do ní mitofagie vstupuje?
Alzheimerova nemoc spočívá v tom, že se v mozku hromadí patologické formy proteinu amyloidu. To poškozuje buňky, až se v důsledku naruší jejich metabolismus. Tím se spustí celá patologická kaskáda, která nakonec vede k jejich smrti – mozkové atrofii – a klinickým projevům. Patologické změny se ovšem objevují i déle než dvacet let před prvními klinickými příznaky. To se teď přijímá jako příčina Alzheimerovy nemoci: na začátku patologický beta amyloid, který následně spouští kaskádu.
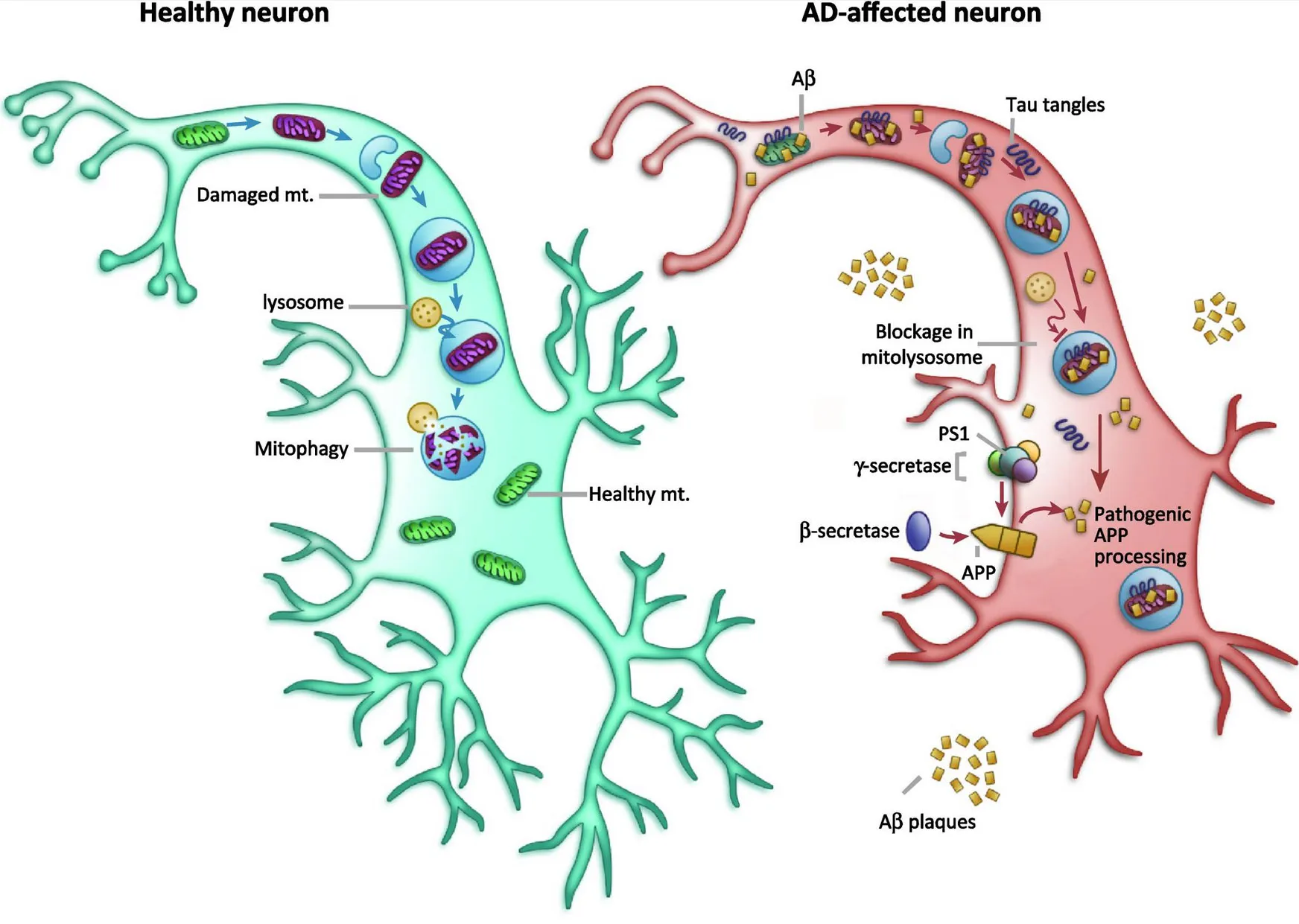
Mitofagie, kterou se zabýváme, je proces recyklace poškozených mitochondrií, který se pravděpodobně nachází na samém počátku této kaskády. Už dříve byla vyslovena i mitochondriální kaskádová hypotéza, podle které se ještě předtím, než se objeví beta amyloid, vyskytne poškozená mitochondrie, a právě ta spouští celou kaskádu.
Podávali myším Urolithin A, a mitofagie se jim skutečně zlepšila, paměť se obnovila, už se neztrácely v bludišti. Mitofagie je klíčový hráč Alzheimerovy nemoci.
Co ovlivňuje kvalitu mitofagie, hraje roli genetika?
Pravděpodobně ano. Bohužel geny pro mitofagii zatím neznáme. Diskutuje se o tom, že mitochondrie se dědí po mateřské linii a je fakt, že ženy mají Alzheimerovu nemoc dvakrát častěji než muži. Tvůrci mitochondriální kaskádovité hypotézy si myslí, že funkce mitochondrií může být narušena geneticky; ony tím pádem dobře nesignalizují, když jsou poškozené. Normálně na sebe totiž mitochondrie nalepí molekulární značky, které buňce signalizují, že je třeba spustit úklid a ty špatné odstranit.
 Alterations of human CSF and serum-based mitophagy biomarkers in the continuum of Alzheimer disease
Alterations of human CSF and serum-based mitophagy biomarkers in the continuum of Alzheimer disease
Kateřina Veverová, Jan Laczó, Alžběta Katonová, Hana Horáková, Veronika Matušková, Francesco Angelucci, Martina Laczó, Zuzana Nedelská, Jakub Hort, He-Ling Wang, Jianying Zhang, Liu Shic, Evandro Fei Fang & Martin Vyhnálek
Autophagy | online 2 May 2024 | doi
Jak se dají uklízet zbytky po mitochondriích? Vašemu kolegovi Evandro F. Fangovi se to povedlo v myším mozku.
Fang s kolegy v roce 2019 publikovali v Nature Neuroscience slavný článek, kterým určili směr výzkumu. Z mozkových buněk mrtvých pacientů s Alzheimerem zjistili, že v nich je mitofagie ve srovnání se zdravými tkáněmi skutečně až o sedmdesát procent nižší. Tak vzali myši s Alzheimerovou nemocí a pokusili se u nich mitofagii aktivovat. Některým podávali Urolithin A, molekulu, která je dnes velmi populární. A těmto myším se mitofagie skutečně zlepšila, buňky se čistily a paměť se obnovila, takže se už neztrácely v bludišti. Množství škodlivin v mozku kleslo. Tím prokázali, že mitofagie není jenom vedlejší produkt narušení buněk, ale klíčový hráč Alzheimerovy nemoci.
Jak konkrétně buňku přimět k úklidu?
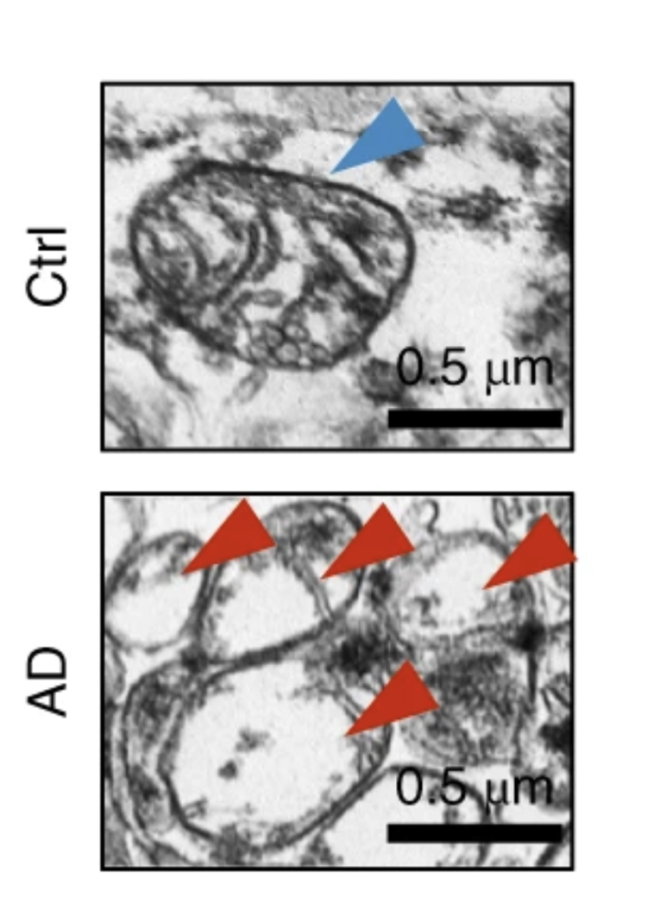
Musíme pomoci mitochondrii, aby uměla říct, že je třeba ji odstranit. Není velký problém mitofagii – léčbu Alzheimerovy nemoci – aktivovat. Stejně jako člověk štěpí proteiny v žaludku, štěpí se poškozené mitochondrie v lysozomu, takovém žaludku buňky. Rozloží se na jednotlivé stavební kameny, z nichž se potom opět postaví nové, funkční mitochondrie. Je ale velmi náročné dovést celý proces až do poslední fáze recyklace. U lidí je to samozřejmě ještě složitější a ukazuje se, že u nich je narušen právě až tenhle finální proces, jejich buňky nedokážou mitochondrie skrze lysozomy správně recyklovat.
Jak náročné je zjistit, v jakém stavu mají pacienti mitofagii?
To nyní zkoumáme. Změnu množství patologického beta amyloidu jsme schopni změřit z mozkomíšního moku už dvacet let před prvním klinickými projevy a pozitronovou emisní tomografií jen chvíli potom. U mitofagie by to teoreticky mělo jít ještě dřív. Tyto změny však na rozdíl od mozkomíšního moku probíhají uvnitř buněk, kde neumíme dobře měřit, navíc u mitofagie jsou proteiny nesmírně drobné a změny jejich hladiny nepatrné. Snažíme se mimo jiné vytvořit platformu pro spolehlivou diagnostiku mitofagie u lidí v časnějších, nebo i preklinických stádiích.

 Aktivátory mitofagie se nacházejí v některých potravinách, například passion fruit neboli mučenka, nebo granátová jablka; tým profesora Fanga izoloval jednu takovou molekulu. A skutečně v Thajsku a dalších zemích, kde jedí tyhle potraviny, se Alzheimerova nemoc vyskytuje méně.
Aktivátory mitofagie se nacházejí v některých potravinách, například passion fruit neboli mučenka, nebo granátová jablka; tým profesora Fanga izoloval jednu takovou molekulu. A skutečně v Thajsku a dalších zemích, kde jedí tyhle potraviny, se Alzheimerova nemoc vyskytuje méně. Ano, podle Davida D’Amica, který vystoupil na naší konferenci, bychom museli sníst asi 250 granátových jablek, abychom získali jeden gram Urolithinu, který se prodává v jedné pilulce. Ovšem jen asi třetina lidí si umí Urolithin metabolicky vyrobit. Nejde ale o to, abyste ve stáří jedl kvanta granátových jablek. Záleží na tom, co už v dětství naučíte svoje buňky.
Ano, podle Davida D’Amica, který vystoupil na naší konferenci, bychom museli sníst asi 250 granátových jablek, abychom získali jeden gram Urolithinu, který se prodává v jedné pilulce. Ovšem jen asi třetina lidí si umí Urolithin metabolicky vyrobit. Nejde ale o to, abyste ve stáří jedl kvanta granátových jablek. Záleží na tom, co už v dětství naučíte svoje buňky.


